Roztwory elektrolitów
Roztwory elektrolitów są szczególneciecze, które są częściowo lub całkowicie w postaci naładowanych cząstek (jonów). Sam proces podziału cząsteczek na ujemne (aniony) i dodatnio naładowane (kationy) cząsteczki nazywa się dysocjacją elektrolityczną. Dysocjacja w roztworach jest możliwa tylko ze względu na zdolność jonów do oddziaływania z cząsteczkami cieczy polarnej, która działa jako rozpuszczalnik.
Jakie są elektrolity?

Roztwory elektrolitów w zależności od stopniadysocjację można podzielić na silną, średnią i słabą. Stopień dysocjacji (α) to stosunek liczby cząsteczek, które uległy rozkładowi do naładowanych cząstek, do całkowitej liczby cząsteczek. W silnych elektrolitach wartość α zbliża się 1, dla średnich α≈ 0,3, a dla słabych α <0,1.
Silne elektrolity zwykle zawierają sole, niektóre kwasy - HCl, HBr, HI, HNO3, H2SO4, HClO4, wodorotlenki baru, strontu, wapnia i metali alkalicznych. Inne zasady i kwasy to średnie lub słabe elektrolity.
Właściwości roztworów elektrolitów
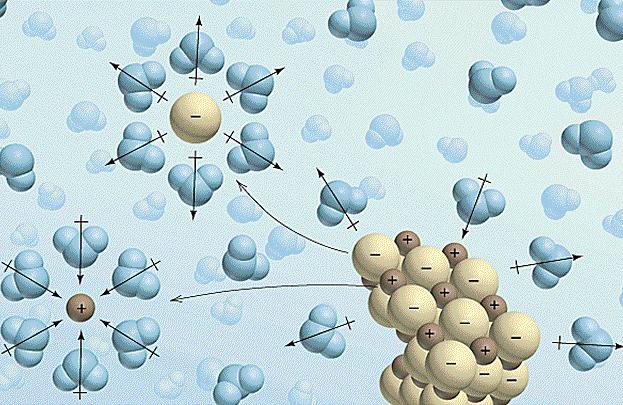
- Zniszczenie międzycząsteczkowych i chemicznych wiązań rozpuszczonego elektrolitu wymaga wydatkowania określonej ilości energii, a zatem zachodzi absorpcja ciepła (ΔHexp > 0).
- Na tym etapie zaczyna się rozpuszczalnikoddziaływać z jonami elektrolitu, powodując powstawanie solwatów (w roztworach wodnych - hydratach). Proces ten nazywa się solwatacją i jest egzotermiczny, tj. E. występuje wydzielanie ciepła (ΔHhydra <0).
- Ostatnim etapem jest dyfuzja. Jest to jednorodny rozkład hydratów (solwatów) w roztworze masowym. Proces ten wymaga kosztów energii i dlatego roztwór jest chłodzony (ΔHdiff > 0).
Tak więc całkowity efekt termiczny rozpuszczenia elektrolitu można zapisać w tej formie:
ΔHraststv = ΔHexp + ΔНhydra + ΔНdiff
Końcowy objaw całkowitego efektu termicznego rozpuszczania elektrolitu zależy od tego, jakie efekty energetyczne wykażą składowe. Zwykle ten proces jest endotermiczny.

W zależności od rozpuszczonegosubstancje, wszystkie roztwory elektrolitów można podzielić na bardzo rozcieńczone (zawierające tylko "ślady" elektrolitu) rozcieńczone (o małej zawartości substancji rozpuszczonej) i zagęszczone (o znacznej zawartości elektrolitu).
Reakcje chemiczne w roztworach elektrolitów,które są spowodowane upływem prądu elektrycznego, prowadzą do uwolnienia pewnych substancji na elektrodach. Zjawisko to nazywane jest elektrolizą i jest często stosowane w nowoczesnym przemyśle. W szczególności, dzięki elektrolizie, otrzymuje się glin, wodór, chlor, wodorotlenek sodu, nadtlenek wodoru i wiele innych ważnych substancji.


