Konfiguracja elektroniczna - sekrety struktury atomu
Jesienią 1910 r. Ernst Rutherford,medytując, próbując zrozumieć wewnętrzną strukturę atomu. Jego eksperymenty na rozpraszaniu cząstek alfa przez różne substancje przekonująco udowodniły - wewnątrz atomu znajduje się masywne ciało, dotychczas nieprzyjęte. W 1912 r. Rutherford nazwał to jądrem atomowym. W głowie naukowca roiły się tysiące pytań. Jaki jest ładunek tego nieznanego ciała? Ile elektronów jest potrzebnych do zapewnienia swojej wagi?

W maju 1911 roku Rutherford opublikował artykuł na tematstruktura atomu, która poprzedza bardzo istotne zastrzeżenie, że stabilność struktury atomowej prawdopodobnie zależy od subtelności wewnętrznej struktury atomu i ruchu naładowanych cząstek, które są jej ważnym składnikiem strukturalnym. Tak narodziła się konfiguracja elektroniczna - jądrowy-elektroniczny model atomowy. Ten model był przeznaczony do odgrywania nieocenionej roli w fizyce jądrowej.

Konfiguracja elektroniczna to kolejnośćrozkład elektronów na orbitach atomowych. Dzięki dociekliwemu umysłowi i wytrwałości Ernsta Rutherforda, któremu udało się obronić swój pomysł, nauka została wzbogacona o nową wiedzę, której znaczenia nie sposób przecenić.
Konfiguracja elektronowa atomu jest następująca. W centrum całej struktury znajduje się jądro składające się z różnej liczby neutronów i protonów dla każdej substancji. Co decyduje o ładunku dodatnim jądra. Wokół niego w odpowiednich koncentrycznych orbitach poruszają się elektrony - ujemnie naładowane cząstki elementarne. Te orbity atomowe nazywane są również powłokami. Zewnętrzna orbita atomu nazywana jest wartościowością. A liczba elektronów na nim jest wartościowa.
Każda elektroniczna konfiguracja elementówróżni się liczbą zawartych w nim elektronów. Na przykład atom najprostszej substancji we wszechświecie - wodór - zawiera tylko jeden pojedynczy elektron, atom tlenu to osiem, a elektronowa konfiguracja żelaza ma dwadzieścia sześć elektronów.
Ale decydująca wartość w modelu elektronicznymatom nie ma w ogóle liczby elektronów, ale to, co je łączy i sprawia, że cały system funkcjonuje prawidłowo - rdzeń i jego skład. Jest to rdzeń, który nadaje substancji jego indywidualne cechy i cechy. Elektrony czasami opuszczają model atomowy, a następnie atom zyskuje ładunek dodatni (dzięki ładunkowi jądrowemu). W tym przypadku substancja nie zmienia swoich właściwości. Ale jeśli zmienisz skład rdzenia, to będzie to zupełnie inna substancja o różnych właściwościach. To nie jest łatwe, ale wciąż jest możliwe.
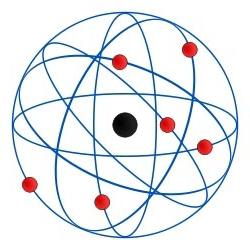
Ponieważ konfiguracja elektroniczna jest niemożliwa bezjej główny element strukturalny - jądro atomowe, powinien zwrócić szczególną uwagę. Jest to centralny element modelu atomowego, który tworzy indywidualne właściwości i cechy każdej substancji chemicznej. Protony, które w rzeczywistości dają jądro dodatni ładunek, są 1840 razy cięższe niż jakikolwiek elektron. Ale siła ładunku protonu jest równa sile dowolnego elektronu. W stanie równowagi liczba protonów w atomie jest równa liczbie elektronów. W tym przypadku jądro jest nośnikiem ładunku zerowego.
Inną ważną cząstką jądra atomowego jest neutron. To ten element, który nie ma ładunku, który umożliwił reakcję nuklearną łańcucha. Zatem nie można przecenić wartości neutronu.







