Właściwości fizyczne i chemiczne siarki
Siarka - dość powszechna w przyrodziepierwiastek chemiczny (szesnasty w skorupie ziemskiej i szósty w wodach naturalnych). Istnieje zarówno rodzima siarka (wolny stan pierwiastka), jak i jej związki.

Siarka z natury
Wśród najważniejszych naturalnych minerałów siarkinazwa pirytów żelaza, sfaleryt, galena, cynober, antymonit. W oceanach występuje głównie w postaci siarczanów wapnia, magnezu i sodu, które określają sztywność naturalnych wód.
Jak zdobywają siarkę?
Ekstrakcję rud siarkowych prowadzi się różnymi metodami. Głównym sposobem wytwarzania siarki jest wytapianie go bezpośrednio w ziemi.
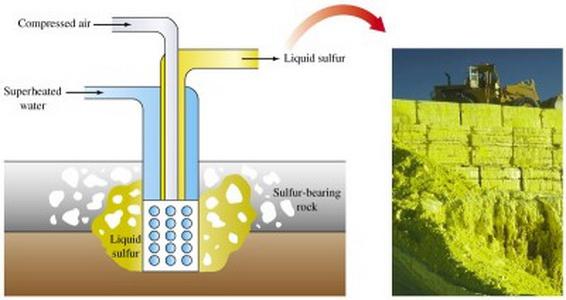
Otwarta metoda ekstrakcji zapewniaWykorzystanie koparek, usuwanie warstw skalnych pokrywających rudę siarki. Po rozdrobnieniu warstw rudy wybuchy są wysyłane do huty.
W przemyśle siarka jest otrzymywana jako produkt ubocznyprocesy produktowe w piecach do topienia, podczas rafinacji ropy naftowej. W dużych ilościach, jest on obecny w gazie ziemnym (w postaci dwutlenku siarki i siarkowodoru), w którym następuje ekstrakcja osadza się na ściankach urządzenia wykorzystywane. Drobno rozproszona siarka, która została pochłonięta z gazu, jest wykorzystywana w przemyśle chemicznym jako surowiec do produkcji różnych produktów.
Tę substancję można uzyskać z naturalnychgazowy dwutlenek siarki. W tym celu stosowana jest metoda Clausa. Polega na zastosowaniu "dołów siarkowych", w których następuje odgazowanie siarki. Rezultatem jest zmodyfikowana siarka, szeroko stosowana w produkcji asfaltu.
Podstawowe alotropowe modyfikacje siarki
Siarka jest nieodłączną częścią alotropii. Znanych jest wiele modyfikacji alotropowych. Najbardziej znane to siarka rombowa (krystaliczna), jednoskośna (igiełkowa) i plastyczna. Pierwsze dwie modyfikacje są stabilne, trzecia przy zestalaniu zamienia się w rombową.

Właściwości fizyczne charakteryzujące siarkę
Cząsteczki rombowego (α-S) i p-jednoskośnej (S) zawierają modyfikacje 8 atomów siarki, które są połączone w zamkniętą pętlę pojedynczych wiązań kowalencyjnych.

W normalnych warunkach siarka ma modyfikację rombową. Jest to żółta stała substancja krystaliczna o gęstości 2,07 g / cm3. Topi się w 113 ° C. Gęstość jednoskośnej siarki wynosi 1,96 g / cm3, jego temperatura topnienia wynosi 119,3 ° C.
Podczas topienia siarka zwiększa objętość istaje się żółtą cieczą, która pęka w temperaturze 160 ° C i zamienia się w lepką ciemnobrązową masę, gdy osiągnie około 190 ° C. W temperaturach przekraczających tę wartość maleje lepkość siarki. W temperaturze około 300 ° C ponownie zmienia się w płynny stan płynny. Wyjaśnia to fakt, że podczas ogrzewania siarka polimeryzuje, zwiększając długość łańcucha wraz ze wzrostem temperatury. A gdy wartość temperatury przekracza 190 ° C, jednostki polimerowe ulegają zniszczeniu.

Gdy stopiony siarka jest chłodzony w sposób naturalnycylindryczne tygle, tak zwane szare diamentowe ząbkowane kryształy, które mają zniekształcony kształt w postaci ośmiościanów z częściowo obciętymi krawędziami lub kątami.
Jeżeli stopiona substancja jest ostrachłodzenie (np. za pomocą zimnej wody), możliwe jest otrzymanie plastycznej siarki, która jest elastyczną gumowatą masą o kolorze brązowym lub ciemnoczerwonym o gęstości 2046 g / cm3. Ta modyfikacja, w przeciwieństwie do rombowych ijednoskośny, jest niestabilny. Stopniowo (w ciągu kilku godzin) zmienia kolor na żółty, staje się kruchy i zamienia się w romb.
Podczas zamrażania oparów siarki (silnie nagrzanych) za pomocą ciekłego azotu powstaje fioletowa modyfikacja, która jest trwała w temperaturach poniżej minus 80 ° C.
W środowisku wodnym siarka jest praktycznie nierozpuszczalna. Jednak charakteryzuje się dobrą rozpuszczalnością w rozpuszczalnikach organicznych. Słaby poprowadzi prąd i ciepło.
Temperatura wrzenia siarki wynosi 444,6 ° C. Procesowi warzenia towarzyszy wydzielanie pomarańczowo-żółtych oparów składających się głównie z S8, które dysocjują po kolejnym podgrzaniu, powodując tworzenie form równowagi S6, S4 i S2. Ponadto, po podgrzaniu, duże cząsteczki rozpadają się, a w temperaturach powyżej 900 stopni, pary składają się zasadniczo tylko z cząsteczek S2, dysocjujące na atomy w 1500 ° C
Jakie są chemiczne właściwości siarki?
Siarka jest typową substancją niemetaliczną. Jest aktywny chemicznie. Utleniająco-Właściwości redukujące siarki przejawiają się ww stosunku do zbioru elementów. Ogrzewany łatwo łączy się praktycznie z wszystkimi pierwiastkami, co wyjaśnia jego obowiązkową obecność w rudach metali. Wyjątki to Pt, Au, I2, N2 i gazy obojętne. Stopień utlenienia, który wykazuje zawartość siarki w związkach, -2, +4, +6.
Właściwości siarki i tlenu powodują jego spalanie w powietrzu. W wyniku tej interakcji powstaje siarka (SO2) i siarkowy (SO3) bezwodniki stosowane do wytwarzania kwasu siarkowego i siarkowego.
W temperaturze pokojowej właściwości redukujące siarki objawiają się tylko w odniesieniu do fluoru, w reakcji, z którą tworzy się sześciofluorek siarki:
- S + 3F2 = SF6.
Po podgrzaniu (w postaci roztopionej) wchodzi w interakcję z chlorem, fosforem, krzemem, węglem. W wyniku reakcji z wodorem, oprócz siarkowodoru, tworzy on siarczany połączone wzorem ogólnym H2SX.
Właściwości utleniające siarki obserwuje się, gdyinterakcja z metalami. W niektórych przypadkach można zaobserwować dość gwałtowne reakcje. W wyniku interakcji z metalami powstają siarczki (związki siarki) i polisiarczki (metale wielosiarkowe).
Przy przedłużonym ogrzewaniu reaguje ze stężonymi środkami utleniającymi kwas, podczas utleniania.
Następnie rozważamy główne właściwości związków siarki.
Dwutlenek siarki
Tlenek siarki (IV), zwany także dwutlenkiem siarkii bezwodnik siarkowy, jest gazem (bezbarwny) z ostrym duszącym zapachem. Ma właściwości upłynniania pod ciśnieniem w temperaturze pokojowej. SO2 jest kwaśnym tlenkiem. Charakteryzuje się dobrą rozpuszczalnością w wodzie. Powoduje to wytwarzanie słabego, niestabilnego kwasu siarkowego, który występuje tylko w roztworze wodnym. W wyniku oddziaływania bezwodnika siarkowego z alkaliami powstają siarczyny.
Różni się raczej wysoką chemiąaktywność. Najbardziej widoczne są redukujące właściwości chemiczne tlenku siarki (IV). Takim reakcjom towarzyszy wzrost stopnia utleniania siarki.
Utleniające właściwości chemiczne tlenku siarki przejawiają się w obecności silnych czynników redukujących (na przykład tlenku węgla).
Tlenek siarki
Trójtlenek siarki (bezwodnik siarki) jest najwyższym tlenkiemsiarka (VI). W normalnych warunkach jest to bezbarwna, lotna ciecz o duszącym zapachu. Ma właściwości zamrażania w temperaturach poniżej 16,9 stopnia. Powstaje mieszanina różnych krystalicznych modyfikacji tritlenku siarki w postaci stałej. Wysokie właściwości higroskopijne tlenku siarki powodują jego "palenie" w wilgotnym powietrzu. W wyniku tego powstają kropelki kwasu siarkowego.
Siarkowodór
Siarkowodór jest dwuskładnikowym związkiem chemicznym wodoru i siarki. H2S jest toksycznym, bezbarwnym gazem, charakterystycznycharakteryzują się słodkawym smakiem i zapachem zgniłych jaj. Topi się przy minus 86 ° С, wrze o temperaturze minus 60 ° С. Jest niestabilny termicznie. Przy temperaturach powyżej 400 ° C siarkowodór rozkłada się do S i H2. Charakteryzuje się dobrą rozpuszczalnością w etanolu. Bardzo źle rozpuszcza się w wodzie. W wyniku rozpuszczania w wodzie tworzy się słaby siarkowodór. Siarkowodór jest silnym czynnikiem redukującym.

Łatwopalny. Kiedy pali się w powietrzu, widać niebieski płomień. W wysokich stężeniach jest w stanie reagować z wieloma metalami.
Kwas siarkowy
Kwas siarkowy (H.2SO4) może mieć różną koncentrację i czystość. W stanie bezwodnym jest bezbarwną oleistą cieczą, która nie ma zapachu.
Temperatura, w której substancjatopi się, wynosi 10 ° C. Temperatura wrzenia wynosi 296 ° C. Dobrze rozpuszcza się w wodzie. Podczas rozpuszczania kwasu siarkowego powstają hydraty i uwalniana jest duża ilość ciepła. Temperatura wrzenia wszystkich roztworów wodnych pod ciśnieniem 760 mm Hg. Art. przekracza 100 ° С. Temperatura wrzenia wzrasta wraz ze wzrostem stężenia kwasu.

Kwaśne właściwości substancji przejawiają się w interakcji z podstawowymi tlenkami i zasadami. H2SO4 dikwasem, a tym samym mogą stanowić siarczanów (medium sole) oraz hydrosulfates (sól kwasowa), z których większość jest rozpuszczalna w wodzie.
Najbardziej wyraźne właściwości kwasu siarkowego przejawiają się w reakcjach utleniania i redukcji. Dzieje się tak, ponieważ w składzie H2SO4 siarka ma wyższy poziom utlenienia (+6). Jako przykład manifestacji właściwości utleniających kwasu siarkowego możemy przytoczyć reakcję z miedzią:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Siarka: użyteczne właściwości
Siarka jest niezbędnym pierwiastkiem śladowymżywe organizmy. Jest integralną częścią aminokwasów (metioniny i cysteiny), enzymów i witamin. Ten pierwiastek bierze udział w tworzeniu trzeciorzędowej struktury białka. Ilość chemicznie związanej siarki zawartej w białkach wynosi wagowo od 0,8 do 2,4%. Zawartość pierwiastka w ludzkim ciele wynosi około 2 gramy na 1 kg wagi (czyli około 0,2% to siarka).
Korzystne właściwości pierwiastka śladowego są trudneprzeceniać. Chroniąc protoplazmę krwi, siarka jest aktywnym pomocnikiem organizmu w walce ze szkodliwymi bakteriami. Koagulacja krwi zależy od jej ilości, to znaczy, że element pomaga utrzymać jej odpowiedni poziom. Siarka odgrywa również ważną rolę w utrzymywaniu normalnych wartości stężenia żółci wytwarzanych przez organizm.
Jest często nazywany "minerałem piękna", ponieważpo prostu konieczne jest zachowanie zdrowia skóry, paznokci i włosów. Siarka charakteryzuje się zdolnością do ochrony ciała przed różnego rodzaju negatywnymi skutkami środowiskowymi. Pomaga to spowolnić proces starzenia. Siarka oczyszcza organizm z toksyn i chroni przed promieniowaniem, co jest szczególnie ważne teraz, biorąc pod uwagę obecną sytuację środowiskową.
Niewystarczająca ilość pierwiastków śladowych w ciele może prowadzić do złego usuwania toksyn, obniżonej odporności i witalności.
Siarka - uczestnik fotosyntezy bakteryjnej. Jest składnikiem bakteriochlorofilu, a siarkowodór jest źródłem wodoru.
Siarka: właściwości i zastosowania przemysłowe
Najpowszechniej stosowaną jest siarka.produkcja kwasu siarkowego. Ponadto właściwości tego materiału, umożliwia jej wykorzystanie do wulkanizacji kauczuku, jak środki grzybobójcze w rolnictwie i nawet leku (koloid siarki). Ponadto, siarka jest wykorzystywane do produkcji zapałek pirotechniczne kompozycji jest częścią do wytwarzania kompozycji serobitumnyh seroasfalta.



